Hóa học là một môn chắc hẳn ai trong số các bạn đều cảm thấy khó và học không hiểu. Thế nhưng đó chỉ là do các bạn chưa biết cách học sao cho đúng. Vì vậy, ngay sau đây chúng ta hãy cùng ôn tập về 1 mảng kiến thức vô cùng quan trọng đối với bộ môn Hóa học. Đó là bảng tính tan Hóa Học đầy đủ và cách học thuộc đơn giản nhất qua bài viết sau đây nhé.
Định nghĩa về độ tan
- Độ tan là một đại lượng đặc trưng cho khả năng tan của một chất tại một điều kiện nhất định.
- Độ tan (S) của một chất trong nước là số gam chất đó hòa tan trong 100 g nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
Độ tan của một chất trong nước
Để có thể biết được rằng một chất có độ tan như thế nào trong nước chúng ta sẽ hòa 100 gam nước hòa tan, chúng ta sẽ thu được kết quả:
- Nếu chất đó > 10 gam chất tan → chất dễ tan hay chất tan nhiều.
- Nếu chất đó < 1 gam chất tan → chất tan ít.
- Nếu chất đó < 0,01 gam chất tan → chất thực tế không tan.
Các em có thể làm thêm ví dụ khác để có thể hiểu hơn về độ tan của một chất trong nước.
Những yếu tố ảnh hưởng đến độ tan của một chất
- Độ tan của một chất phụ thuộc vào nhiều yếu tố đó là: nhiệt độ, áp suất và bản chất của chất.
- Với chất rắn, độ tan phụ thuộc vào nhiệt độ thường, nếu nhiệt độ tăng thì độ tan tăng.
- Còn với chất khí thì độ tan phụ thuộc vào sự tăng nhiệt độ hoặc giảm áp suất thì độ tan giảm.
Để có thể hiểu hơn chúng ta có một ví dụ sau đây:
Khi hoà tan đường vào cốc nước nóng đường sẽ tan nhanh hơn. Còn khi hoà tan đường vào cốc nước lạnh thì độ tan của đường sẽ bị giảm đi. Vậy để hiểu rõ hơn các em có thể tự làm ở nhà để có thể hiểu hơn về ví dụ trên.
Bảng tính tan hóa học thường gặp
Đây là 1 trong số bảng tính tan các em hay gặp để làm bài tập:
Bảng 1: Bảng tính tan thường gặp
| AxêtatCH3COO− | Bromua Br− |
Cacbonat CO32− |
Clorua Cl− |
Clorat ClO3− |
Hiđrôxít OH− |
Nitrat NO3− |
Ôxit O2− |
Phosphat PO43− |
Sulfat SO42− |
Dicromat Cr2O72− |
|
| Amoni NH4+ |
T | T | T | T | T | T | T | _ | T | T | T |
| Bạc Ag+ |
T | K | K | K | T | _ | T | K | K | I | K |
| Canxi Ca2+ |
T | T | K | T | T | II | T | I | K | I | K |
| Đồng(II) Cu2+ |
T | T | _ | T | T | K | T | K | K | T | K |
| Kali K+ |
T | T | T | T | T | T | T | T | T | T | T |
| Kẽm Zn2+ |
T | T | K | T | T | K | T | K | K | T | K |
| Natri Na+ |
T | T | T | T | T | T | T | T | T | T | T |
| Magie Mg2+ |
T | T | K | T | T | K | T | K | K | T | K |
| Nhôm Al3+ |
T | T | _ | T | T | K | T | K | K | T | K |
| Sắt (II) Fe2+ |
T | T | K | T | T | K | T | K | K | T | K |
| Sắt (III) Fe3+ |
T | T | _ | T | T | K | T | K | K | I | K |
Trong đó:
- – : Là hợp chất bị phân hủy hoặc không tồn tại trong nước.
- I : Hợp chất ít tan
- T: Hợp chất tan trong nước
- K: Hợp chất không tan trong nước
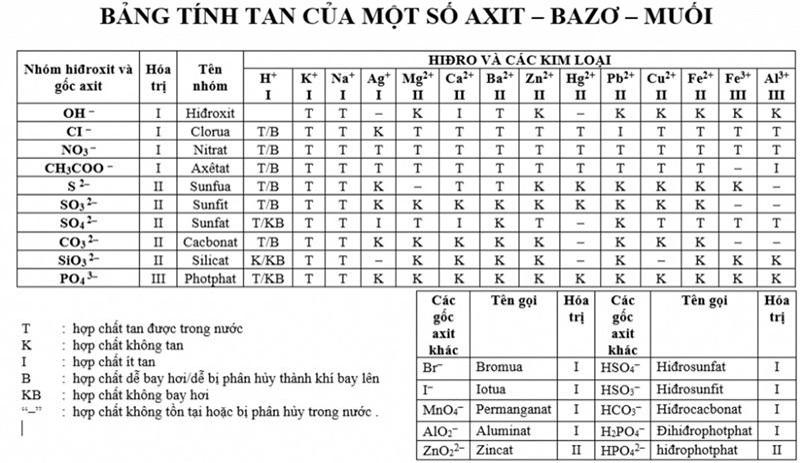
Bảng 2: Bảng tính tan trong nước của các chất Bazơ,Axit và Muối
| Nhóm hiđro và gốc axit | Hiđro và các kim loại | |||||||||||||
| HI | KI | NaI | AgI | MgII | CaII | BaII | ZnII | HgII | PbII | CuII | FeII | FeIII | AlIII | |
| OH | t | t | – | k | i | t | k | – | k | k | k | k | k | |
| CL | t/b | t | t | k | t | t | t | t | t | i | t | t | t | t |
| NO₃ | t/b | t | t | t | t | t | t | t | t | t | t | t | t | t |
| CH₃COO | t/b | t | t | t | t | t | t | t | t | t | t | t | – | i |
| = S | t/b | t | t | k | – | t | t | k | k | k | k | k | k | – |
| = SO₃ | t/b | t | t | k | k | k | k | k | k | k | k | k | – | – |
| = SO₄ | t/kb | t | t | i | t | i | k | t | – | k | t | t | t | t |
| = SO₃ | t/b | t | t | k | k | k | k | k | – | k | k | k | – | – |
| = SiO₃ | t/kb | t | t | – | k | k | k | k | – | k | – | k | k | k |
| = PO₄ | t/kb | t | t | k | k | k | k | k | k | k | k | k | k | k |
Trong đó:
- t : hợp chất tan trong nước.
- k : hợp chất không tan.
- i : Hợp chất ít tan.
- b: Hợp chất bay hơi hoặc dễ phân hủy khi bay lên.
- kb:Hợp chất không bay hơi.
- “-“:Hợp chất không tồn tại hoặc bị phân hủy trong nước.
Chú ý: Một số đặc điểm chung của Bazơ, Axit và Muối:
- Axit: Hầu hết các axit đều tan trong nước, trừ Axit Silicic [SiOx(OH)₄-2x]n như H₂SiO₃, H₄SiO₄,…
- Bazơ: Các bazơ hầu hết không thể tan trong nước trừ một số hợp chất như : KOH, NaOH…
- Muối: Muối kali, natri đều tan; muối nitrat đều tan; hầu hết muối clorua, sunfat đều tan được nhưng hầu như các muối cacbonat đều không tan.

Cách học thuộc bảng tính tan nhanh nhất
Do bảng tính tan rất khó để nên chúng ta có thể đọc thành thơ để có thể hiểu hơn và nhớ bài một cách nhanh nhất như sau :
“Bazơ, những chú không tan:
Đồng, nhôm, crôm, kẽm, mangan, sắt, chì
Ít tan là của canxi
Magiê cũng chẳng điện li dễ dàng.
Muối kim loại kiềm đều tan
Cũng như nitrat và “nàng” hữu cơ
Muốn nhớ thì phải làm thơ!
Ta làm thí nghiệm bây giờ thử coi.
Kim koại I (IA), ta biết rồi,
Những kim loại khác ta “moi” ra tìm
Photphat vào nước đứng im (trừ kim loại IA)
Sunfat một số “im lìm trơ trơ”:
Bari, chì với S-r
Ít tan gồm bạc, “chàng khờ” canxi,
Còn muối clorua thì
Bạc đành kết tủa, anh chì cố tan (giống Br‾ và I‾)
Muối khác thì nhớ dễ dàng:
Gốc SO₃ chẳng tan chút nào! (trừ kim loại IA)
Thế gốc S thì sao? (giống muối CO₃²‾)
Nhôm không tồn tại, chú nào cũng tan
Trừ đồng, thiếc, bạc, mangan, thuỷ ngân, kẽm, sắt không tan cùng chì.”
Như vậy qua bài viết hôm nay chúng ta đã có thể nhớ lại và ôn tập lại về bảng tính tan. Hi vọng với những kiến thức bổ ích về bảng tính tan Hóa Học đầy đủ và cách học thuộc đơn giản nhất sẽ giúp các em có thể ôn tập và rèn luyện lại kiến thức cho mình một cách tốt nhất và hiệu quả nhất.